Procedimiento de Autorización/Registro (AA) de un producto biocida
La solicitud de registro por el procedimiento de Autorización/Registro de un producto biocida en España, en el caso de ser la primera solicitud en la Unión Europea de dicho producto bajo la Directiva 98/8/CE, deberá contener la siguiente documentación:
1. FORMULARIO DE SOLICITUD
1.1. Formulario de Solicitud R4BP del Registro Comunitario de Biocidas.
El futuro titular de la autorización/registro y responsable de la comercialización del biocida en nuestro país, deberá acceder al Registro Comunitario de Biocidas - R4BP -
 e introducir en el Formulario de solicitud los datos de la industria y del producto biocida a registrar/autorizar. Dicho Formulario deberá presentarse fechado y firmado.
e introducir en el Formulario de solicitud los datos de la industria y del producto biocida a registrar/autorizar. Dicho Formulario deberá presentarse fechado y firmado.
Importante: Antes de acceder a la Base de Datos europea, es conveniente familiarizarse con su uso realizando un ensayo previo en la versión de prueba del programa, cuyo enlace es: https://webgate.acceptance.ec.europa.eu/r4bp
 . Para más información, consulte la guía del usuario
. Para más información, consulte la guía del usuario
 .
.
1.2. Formulario Oficial de Biocidas en el Estado Español.
En vistas a obtener una solicitud válida en el Estado Español, deberá acompañarse el Formulario Oficial de Biocidas
 en España como información adicional al Formulario R4BP y por el que se solicita la autorización/registro del producto que se referencia, en el REGISTRO OFICIAL DE BIOCIDAS DE LA DIRECCIÓN GENERAL DE SALUD PÚBLICA, CALIDAD E INNOVACIÓN.
en España como información adicional al Formulario R4BP y por el que se solicita la autorización/registro del producto que se referencia, en el REGISTRO OFICIAL DE BIOCIDAS DE LA DIRECCIÓN GENERAL DE SALUD PÚBLICA, CALIDAD E INNOVACIÓN.
Las empresas domiciliadas en España, deberán adjuntar a dicho formulario, copia de la inscripción en el Registro Oficial de Establecimientos y Servicios Biocidas (ROESB).
2. DOCUMENTACIÓN TÉCNICA:
-
Certificado de análisis cualitativo y cuantitativo de los ingredientes activos realizado sobre una muestra del producto y llevado a cabo por un laboratorio certificado al menos con norma ISO 9001 y en el que figurará el número de lote de la muestra, y declaración del solicitante que acredite que la composición del producto analizado coincide con la del producto que se intenta poner en el mercado. (Traducción jurada de los documentos si no están en inglés o español).
-
Ficha de datos de seguridad (FDS) del PRODUCTO y etiquetado en español, y Ficha de datos de seguridad (FDS) de CADA UNO DE LOS COFORMULANTES, en español o en inglés.
-
Propuesta de Resumen de las Características del Producto. Documento en inglés
 y en español
y en español
 .
. -
Documentación del Dossier de Evaluación conforme al artículo 8 del Real Decreto 1054/2002 (Artículo 8 de la Directiva 98/8/CE de biocidas) (Traducción jurada si no están en inglés o español), que se estructura en 4 documentos, tal y como se describe en la Guía Técnica para la elaboración del dossier Parte I
 , Parte II
, Parte II
 , Parte III
, Parte III
 :
:-
Documento IV, formado por los estudios originales para cada de uno los requisitos a presentar en el expediente, tanto para la sustancia activa (Documento IVA a través de la carta de acceso) como para el producto biocida (Documento IVB).
En cuanto a los ensayos de seguridad (toxicológicos y eco-toxicológicos) deberán realizarse en laboratorios con Buenas Prácticas de Laboratorio (BPL).
Respecto a la demostración de la Eficacia, existen normas o directrices internacionalmente aceptadas para algunos tipos de producto, mientras que para otros se encuentran en preparación. Actualmente se aplican los siguientes criterios:
- Para desinfectantes TP2 y TP4
 :
: - Para protectores de madera TP8
 :
: - Para desinfectantes TP11
 :
: - Para raticidas TP14
 :
: - Para insecticidas/acaricidas y repelentes/atrayentes TPs 18 y 19
 (documento en trámite de adopción
(documento en trámite de adopción
 ).
).
La acreditación de la Eficacia requiere que el ensayo se realice con el producto que va a comercializarse.
Los ensayos de eficacia se realizarán por laboratorios acreditados mediante la norma ISO 17.025. En caso de duda, es conveniente contactar previamente con el Área de Biocidas y Productos Químicos de la Dirección General de Salud Pública, Calidad e Innovación, con objeto de asegurar que el diseño de los estudios programados va a ser aceptado (sin perjuicio de la evaluación posterior de la calidad de la ejecución y de los resultados).
En todo caso, se deberá presentar la certificación del ensayo así como la acreditación del laboratorio por la Entidad Nacional de Acreditación (ENAC) o por las entidades de acreditación oficialmente reconocidas en otros Estados Miembros de la Unión Europea, excepto los casos en los que los ensayos de eficacia no estén normalizados.
- Para desinfectantes TP2 y TP4
-
Documento III, formado por las tablas resumen de los anteriores estudios, tanto para la sustancia activa (Documento IIIA, a través de la carta de acceso) como para el producto biocida (Documento IIIB) , o bien la justificación adecuada en caso de exención de los datos, ambos en el formato establecido Guía Técnica para la elaboración del dossier Parte I
 , Parte II
, Parte II
 , Parte III
, Parte III
 .
. -
Documento II, incluye la Evaluación del Riesgo y la Demostración de la Eficacia y está estructurado en Documento IIA (a través de la carta de acceso), Documento IIB (Efectos y evaluación de la Exposición al producto biocida así como la eficacia del producto) y Documento IIC (Caracterización del Riesgo).
-
Para elaborar este documento se pueden seguir varias directrices, entre otras, la Guía Técnica para la Evaluación del Riesgo
 , la Guía Técnica para la Inclusión en el Anexo I
, la Guía Técnica para la Inclusión en el Anexo I
 (y las revisiones del capitulo 10
(y las revisiones del capitulo 10
 y del capitulo 4.1
y del capitulo 4.1
 ), las Guías Técnicas para la evaluación de la Exposición Humana
), las Guías Técnicas para la evaluación de la Exposición Humana
 , (aquí encontrará una adaptación en español de este documento
, (aquí encontrará una adaptación en español de este documento
 , consistente en una traducción NO literal de la Guía Técnica), así como distintos escenarios de emisión
, consistente en una traducción NO literal de la Guía Técnica), así como distintos escenarios de emisión
 . En las Guías Técnicas para la evaluación de la Exposición Humana se incluye una base de datos de patrones de uso para profesionales que proporciona valores predeterminados, por defecto, para la duración y la frecuencia de las diferentes tareas para cada tipo de producto biocida y para tipos de formulaciones diferentes. La base de datos viene en formato excel y puede visualizarse aquí
. En las Guías Técnicas para la evaluación de la Exposición Humana se incluye una base de datos de patrones de uso para profesionales que proporciona valores predeterminados, por defecto, para la duración y la frecuencia de las diferentes tareas para cada tipo de producto biocida y para tipos de formulaciones diferentes. La base de datos viene en formato excel y puede visualizarse aquí
 .
.La Evaluación del Riesgo incluirá una Determinación de los peligros, una Evaluación de la dosis - respuesta, una Evaluación de la exposición y en último lugar una Caracterización del riesgo. Dicha Evaluación debe efectuarse teniendo en cuenta las propiedades físico-químicas, así como la Salud Humana
 y el Medio Ambiente
y el Medio Ambiente
 .
. -
Documento I: proporciona un resumen general y una propuesta de decisión de autorización/registro, e incluirá además:
- Listado de puntos finales (Listing of End Points), en el formato establecido en la Guía Técnica para la elaboración del dossier Parte I
 , Parte II
, Parte II
 , Parte II
, Parte II
 .
. - Listado de abreviaturas.
-
Listado para la validación de la documentación
 .
.
- Listado de puntos finales (Listing of End Points), en el formato establecido en la Guía Técnica para la elaboración del dossier Parte I
-
El siguiente esquema muestra la estructura de la documentación de un dossier de evaluación, incluidos los datos de la sustancia activa. Puesto que la autorización/registro de productos biocidas implica que las sustancias activas están ya incluidas en el Anexo I de la Directiva 98/8/CE y del Real Decreto 1054/2002, los datos concernientes a ésta pueden ser proporcionados en forma de Carta de Acceso* , si el solicitante no es el propietario de estos datos, como se ha indicado anteriormente para los documentos IVA, IIIA y IIA.
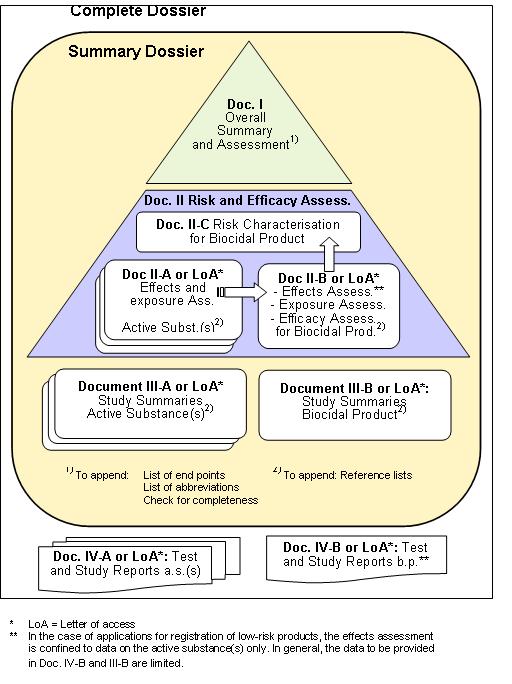
* Carta de acceso o LoA es el documento de declaración de acceso a los datos, bien de una sustancia activa, bien de un producto biocida, por parte del propietario de los mismos o representante legal de este. En la carta de acceso se deberá declarar que el objetivo del uso de dichos datos será la autorización/registro de un producto biocida, y será ejercido por la Autoridad Competente para el beneficio del futuro titular del producto biocida en España. La información disponible en dicho documento original deberá ser:
- nombre y datos de contacto del propietario de los datos y del beneficiario.
- nombre de la sustancia activa o producto biocida objeto del uso de los datos.
- nombre del producto biocida en vías de autorización/registro.
- fecha de emisión de la carta de acceso.
- lista de los datos o lista de referencia a los datos (lista de estudios), cuyo acceso es concedido.
- sello y firma de/los propietario(s) de los datos.
En el caso de productos que vayan a autorizarse/registrarse y comercializarse exclusivamente en España, se admitirá la presentación del expediente en español (incluyendo la sección X del Anexo IIB del Real Decreto 1054/2002).
3. PAGO DE TASAS
-
Si se trata de Empresas domiciliadas en España:
Las tasas deben ser formalizadas mediante el impreso de tasas Modelo 790 código 081 cuya cuantía será la que corresponda a la solicitud. Este impreso puede recogerse en el Registro General del Ministerio de Sanidad, Servicios Sociales e Igualdad, presencialmente o por teléfono, en el 915961185.
En caso de realizar el pago al tesoro público a través de internet, es imprescindible que se adjunte el justificante del pago de tasas junto con el resto de la documentación.
-
Si se trata de Empresas NO domiciliadas en España:
En el caso de solicitantes domiciliados en otros países de la Unión Europea, el pago de las tasas se realizará mediante el ingreso de las mismas en la cuenta corriente que se indica en el documento de cuantía de tasas. Se recuerda a dichas empresas la importancia de presentar el justificante de haber abonado las tasas, junto con la solicitud.
Finalmente, una vez completado el expediente de solicitud del procedimiento de Autorización/Registro de un biocida, que deberá constar de:
- Formulario nacional de solicitud y Formulario de solicitud R4BP debidamente fechados y firmados.
- Documentación técnica completa.
- Justificante o prueba del pago de tasas.
- Número necesario de copias del expediente: 1 copia en papel y 3 copias en formato CD (incluyendo el resumen de las características del producto, fichas de datos de seguridad, etiquetado y carta/s de acceso).
deberá ser dirigido a la Ilma. Sra. Directora General de Salud Pública, Calidad e Innovación y presentado ante la Dirección General de Salud Pública y Sanidad Exterior del Ministerio de Sanidad, Servicios Sociales e Igualdad en su Registro General, o bien por los medios admitidos en la Ley 30/1992, de Régimen Jurídico de las Administraciones Públicas y del Procedimiento Administrativo común.
Documentación de interés
- Legislación sobre productos químicos y biocidas
-
Principios Básicos
 del proceso de implementación de la Directiva 98/8 de biocidas
del proceso de implementación de la Directiva 98/8 de biocidas -
Manual de decisiones para la aplicación de la Directiva 98/8/CE sobre la puesta en el mercado de los biocidas
 (MoD). El solicitante debe considerar los usos a los que se dirige el biocida, con objeto de solicitar su autorización o registro dentro del tipo de producto que realmente le corresponda.
(MoD). El solicitante debe considerar los usos a los que se dirige el biocida, con objeto de solicitar su autorización o registro dentro del tipo de producto que realmente le corresponda. - Guía Técnica para la elaboración del dossier Parte I
 , Parte II
, Parte II
 , Parte II
, Parte II
 incluía la evaluación de los resúmenes de estudio.
incluía la evaluación de los resúmenes de estudio. -
Guía Técnica sobre los Requerimientos de los Datos

- Páginas 53 a 67: Presentación del dossier.
- Páginas 81 y siguientes: Si el biocida es un producto químico, debe añadirse la información requerida en dichas páginas.
- Para el caso de que se trate de productos que sean microorganismos
 productos de los tipos 14
productos de los tipos 14
 , 18 (aceites y extractos de origen vegetal
, 18 (aceites y extractos de origen vegetal
 ) y 19 (sustancias de origen natural
) y 19 (sustancias de origen natural
 ) y feromonas
) y feromonas
 , existen guías específicas.
, existen guías específicas.
-
Guía Técnica para la Inclusión en el Anexo I
 y las revisiones del capítulo 10
y las revisiones del capítulo 10
 y del capítulo 4.1
y del capítulo 4.1

-
Guía Técnica para la Evaluación del Producto
 y las revisiones del capítulo 7
y las revisiones del capítulo 7
 y del capítulo 6.2
y del capítulo 6.2

-
Guías Técnicas para la evaluación de la Exposición Humana

-
Guía Técnica para la Evaluación del Riesgo

-
Escenarios de emisión

Páginas web de interés
-
http://echa.europa.eu

-
http://ecb.jrc.ec.europa.eu/

-
http://ec.europa.eu/environment/chemicals/reach/reach_intro.htm

-
http://ec.europa.eu/enterprise/reach/index_en.htm

-
http://ec.europa.eu/environment/biocides/index.htm

- http://www.msc.es/ciudadanos/saludAmbLaboral/prodQuimicos/home.htm
-
http://www.oecd.org/document/40/0,3343,en_2649_34377_37051368_1_1_1_1,00.html

Si desitja localitzar informació relacionada amb el contingut d'aquesta pàgina, utilitzi el cercador