Actualización en vacunas frente al SARS-CoV-2
Autor: Agustín Portela Moreira.
Jefe del Servicio de Biotecnología, Departamento de Medicamentos de Uso Humano de la AEMPS.
Tres artículos recientes repasan como está evolucionado el campo de las vacunas frente al SARS-CoV-2(1,2,3).
Como se puede ver en la siguiente tabla tomada del articulo del NEJM(1) se están explorando varias estrategias, y en cada una de ellas hay varias Compañías trabajando.
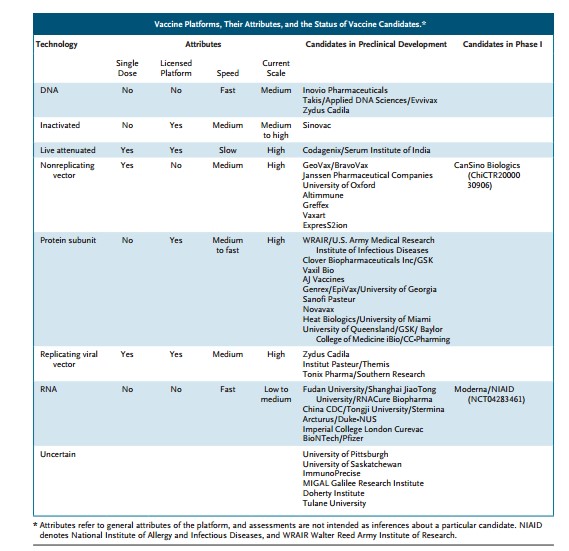
Excepto las dos primeras aproximaciones (coronavirus inactivado o atenuado), el resto están basadas en la proteína S del virus, que es la proteína que se une al receptor celular y media la actividad de fusión de membranas. Se trataría de vacunas basadas en:
- Proteína S recombinante purificada (obtenida por ingeniería genética), bien como proteína completa, como un fragmento o como proteína de fusión (protein subunit en la tabla). Este abordaje se ha utilizado ya en muchas vacunas autorizadas (entre ellas, hepatitis B, virus papiloma humano, y gripe).
- Proteína S expresada in vivo a partir de un virus recombinante (non-replicating y replicating viral vector en la tabla). Es una aproximación similar a la utilizada con las vacunas frente al Ébola, en los cuales las proteínas del virus Ébola se expresan a partir de un virus de la estomatitis vesicular (VSV Ervebo®), un adenovirus humano (Ad3, Ad5 y Ad26) o de chimpancé (ChAd3); o un virus vacunal recombinante (cepa MVA). Brevemente, se explica a continuación la aproximación basada en adenovirus. Los adenovirus son virus que infectan el tracto respiratorio sin causar enfermedad grave. Mediante técnicas de ingeniería genética se eliminan genes esenciales del adenovirus y se insertan el de la proteína S del SARS-CoV-2, de manera que el adenovirus recombinante resultante puede infectar una célula, expresar la proteína S, pero ha perdido la capacidad de generar nuevos virus y por tanto no se multiplicarían en el vacunado.
- Proteína S expresada a partir de una vacuna basada en ácidos nucleicos (RNA o DNA). La vacuna consistirá de un ácido nucleico que contendría el gen de la proteína S, y tras inyección en el vacunado entraría en las células y produciría dicha proteína.
Por la experiencia previa, se prevé que las vacunas basadas en proteínas recombinantes generarían una respuesta humoral (de anticuerpos) fuerte, mientras las basadas en virus recombinantes generarían, dependiendo del abordaje, una menor respuesta de anticuerpos, pero como contrapartida inducirían una importante respuesta celular que no generan las vacunas basada en proteínas purificadas. Es adecuado que se trabaje en diferentes abordajes pues unos pueden dar lugar a vacunas más eficaces y seguras que otros. No obstante, es muy probable que distintas aproximaciones den lugar a vacunas óptimas frente al SARS-CoV-2.
Con el objeto de armonizar a nivel mundial el avance rápido en el desarrollo de vacunas, manteniendo los criterios que aseguren que se vigile la seguridad en la persona que entran a formar parte los ensayos clínicos, se ha celebrado recientemente una reunión con las Agencias Reguladoras de varios continentes. De esta reunión han salido recomendaciones sobre cómo desarrollar la experimentación preclínica necesaria antes de empezar ensayos clínicos en humanos(4). Hasta ahora, antes de ensayar ninguna vacuna en humano era siempre necesario tener un paquete exhaustivo de experimentación preclínica en animales. En esta situación excepcional se ha consensuado que, caso por caso y basados en la experiencia previa con vacunas similares, se puedan iniciar ensayos en Fase I mientras se completa el paquete de experimentación preclínica. Por ello, como se indica en la Tabla, hay dos vacunas, una basada en RNAs y otra en adenovirus de las compañías Moderna y CanSino Biologics respectivamente, que acaban de iniciar ensayos en Fase I en adultos sanos sin que aún se hayan completado los datos preclínicos.
En los artículos mencionados anteriormente(1,2,3) se resalta, además de los aspectos científico/técnico de desarrollo de las vacunas, varios aspecto de otra índole, como el que muchas de estas Compañías no tienen la capacidad para producir los miles de millones de dosis que serán necesarias a nivel mundial, y que sería muy importante contar con una financiación a nivel mundial para disponer de suficiente vacuna y para asegurar además que las vacunas, unas vez disponibles, lleguen a todos los países que la necesiten. En este sentido es muy relevante que la compañía Johnson and Johnson y el departamento de salud de EEUU hayan alcanzado un acuerdo para poner, entre los dos, mil millones de dólares para desarrollar una vacuna que estaría lista para principios de 2021(5).
Por último, recientemente también están apareciendo artículos de opinión que plantean la posibilidad de hacer estudios de inoculación del virus en humanos(6,7). Se administraría la vacuna a un grupo reducido de personas, a las que una vez transcurrido el tiempo necesario para que generen inmunidad, se les inocularía intranasalmente el virus SARS-CoV-2. Esta aproximación ya se ha utilizado anteriormente en el desarrollo de otras vacunas (cólera, gripe, etc.). Este tema está en debate y plantea cuestiones científicas (¿Con cuánto virus hay que infectar a las personas?, ¿Cómo medir disminución en la gravedad de la enfermedad?), éticos (¿Se pueden hacer estos estudios sin que haya ningún tratamiento antiviral eficaz para evitar que algún sujeto sufra una enfermedad grave?, ¿Deberían ser los sujetos personal sanitario que conozca los riesgos?) y regulatorios (¿Cómo podemos trasladar los resultados de estos estudios en términos de eficacia y seguridad en la población general y en particular a varios grupos de edad y de riesgo?). De momento ahí está el debate, pero si se sigue adelante con estos estudios el desarrollo de la vacuna será más rápido, y eso es algo que necesitamos con urgencia.
En conclusión, el desarrollo de la vacuna frente al SARS-CoV-2 avanza muy rápido como nunca antes se había hecho para desarrollar ninguna otra vacuna. Hace falta una visión nueva y diferente, para que, sin comprometer el adecuado diseño de los ensayos clínicos en humanos, se pueda alcanzar el éxito de disponer de una vacuna segura y eficaz en el plazo más breve posible.
BIBLIOGRAFÍA:
- Nicole Lurie, Melanie Saville, Richard Hatchett, and Jane Halton. Developing Covid-19 Vaccines at Pandemic Speed. NEJM. 30.03.2020. Disponible en: https://www.nejm.org/doi/full/10.1056/NEJMp2005630?url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org&rfr_dat=cr_pub%3Dpubmed
- Jon Cohen. Vaccine designers take first shots at COVID-19. Science. 3.04.2020. Disponible en: https://science.sciencemag.org/content/368/6486/14
- Gavin Yamey, Marco Schäferhoff, Richard Hatchett, Muhammad Pate, Feng Zhao, Kaci Kennedy McDade. Ensuring global access to COVID-19 vaccines. LANCET. 31.03.2020. Disponible en: https://linkinghub.elsevier.com/retrieve/pii/S0140-6736(20)30763-7
- EMA. Global regulators map out data requirements for phase 1 COVID-19 vaccine trials. 24.03.2020. Disponible en: https://www.ema.europa.eu/en/news/global-regulators-map-out-data-requirements-phase-1-covid-19-vaccine-trials
- Johnson & Johnson. Johnson & Johnson Announces a Lead Vaccine Candidate for COVID-19; Landmark New Partnership with U.S. Department of Health & Human Services; and Commitment to Supply One Billion Vaccines Worldwide for Emergency Pandemic Use. 30.03.2020. Disponible en: https://www.jnj.com/johnson-johnson-announces-a-lead-vaccine-candidate-for-covid-19-landmark-new-partnership-with-u-s-department-of-health-human-services-and-commitment-to-supply-one-billion-vaccines-worldwide-for-emergency-pandemic-use
- Jon Cohen. Infect volunteers to speed a coronavirus vaccine? 03.04.2020. Disponible en: https://science.sciencemag.org/content/368/6486/16
- Nir Eyal, Marc Lipsitch and Peter G. Smith. Human Challenge Studies to Accelerate Coronavirus Vaccine Licensure. 18.04.2020. Disponible en: https://academic.oup.com/jid/advance-article/doi/10.1093/infdis/jiaa152/5814216
Si desea localizar información relacionada con el contenido de esta página, utilice el buscador